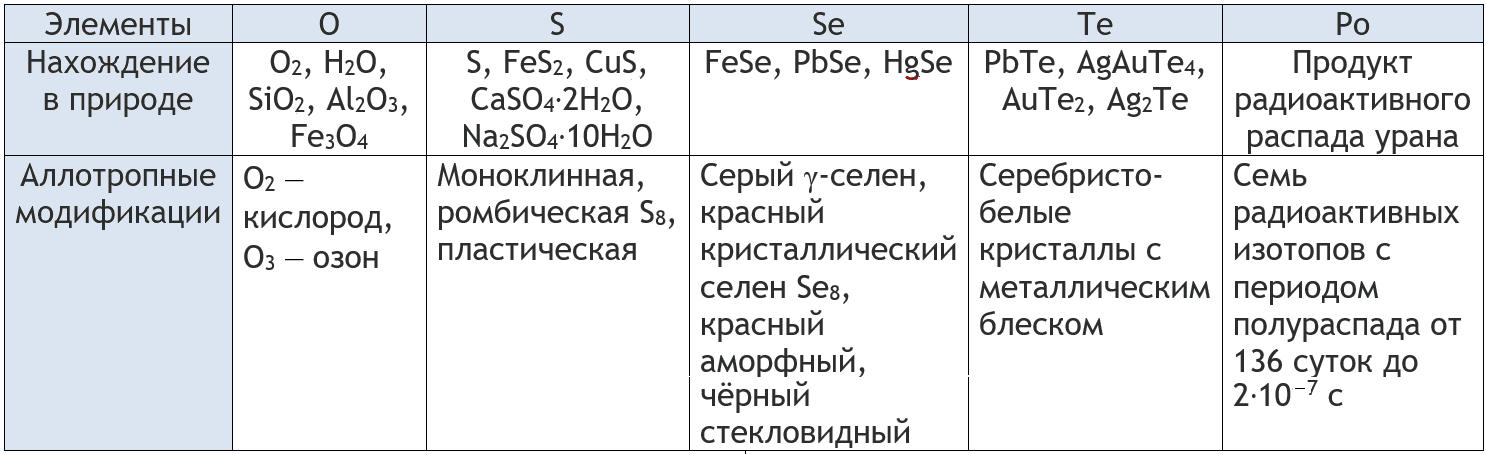
- Элементы VI группы главной подгруппы Периодической системы называют халькогенами. К ним относятся неметаллы кислород О, сера S, селен Se, теллур Te и металл полоний Ро. На внешнем электронном слое атомов этих элементов находится 6 электронов: два s и четыре р-электрона.
- Кислород получают ректификацией жидкого воздуха или электролизом воды, в лаборатории – разложением KClO3, KMnO4, KNO3, H2O2. Серу получают выплавкой с последующей очисткой из самородной серы.
- Кислород и озон – сильные окислители: О2 + С = СО2; 2Cu + O2 = 2CuO;
O3 + NO = NO2 + O2; 3O3 + KI = KIO3 + 3O2.
- Сера – более слабый окислитель, чем кислород: Cu + S = CuS; S + H2 = H2S.
- В реакциях с сильными окислителями сера проявляет восстановительные свойства: S + О2 = SО2; S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O.
- Сера может присоединяться к кратным связям алкенов, образуя дисульфидные мостики. На этом свойстве основан процесс вулканизации каучука.
Нахождение в природе и аллотропные модификации халькогенов