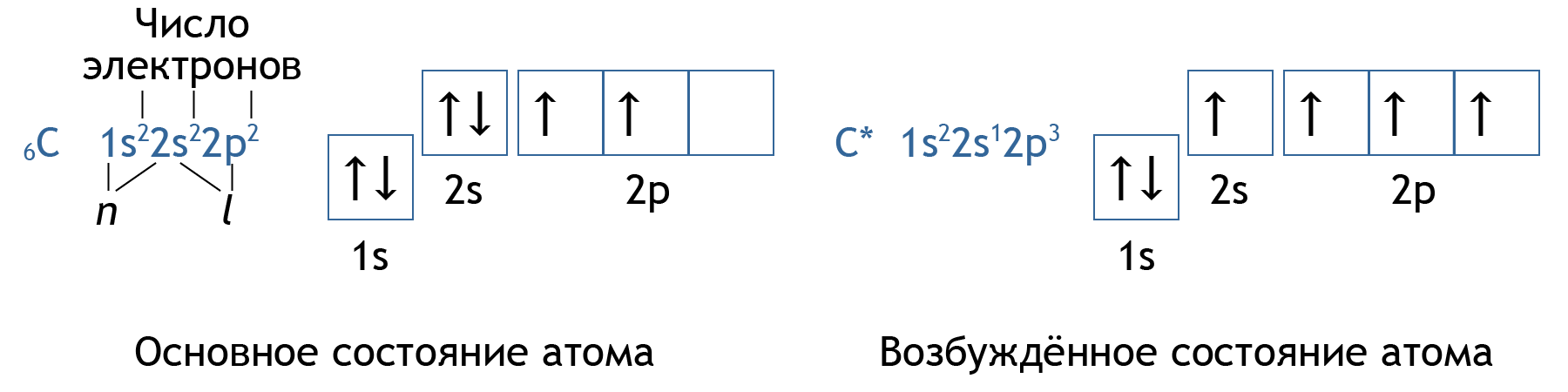
- Электронная конфигурация – изображённое в виде формулы распределение электронов по орбиталям в атоме.
- Принцип Паули: в атоме не может быть двух электронов с одинаковым набором квантовых чисел.
- Следствие: на одной атомной орбитали может быть не более 2 электронов; максимальная ёмкость подуровней: s — 2, p — 6, d — 10, f — 14 электронов.
- Правило Хунда: электроны заполняют подуровень так, чтобы суммарное спиновое число было максимальным.
- Принцип минимума энергии: электроны заполняют подуровни в порядке возрастания суммы (
n +l ). Если для двух подуровней сумма (n +l ) одинаковая, первым заполняется подуровень с меньшимn . - Количество электронов в электронной конфигурации ионов отличается на число отданных или принятых электронов:
11Na0 1s22s22p63s1 и 11Na⁺ 1s22s22p63s0.
- При получении дополнительной энергии атом переходит в возбуждённое состояние, электроны при наличие свободных орбиталей в пределах данного уровня могут распариваться, переходить на свободную орбиталь.