- Аммиак – гидрид азота NH3, степень окисления азота −3. Бесцветный газ с характерным запахом, легче воздуха, растворим в воде.
- Раствор аммиака в воде NH3⋅H2O – гидроксид аммония – слабое основание:
;
- Аммиак проявляет только восстановительные свойства:
4NH3 + 5O2 = 6H2O + 4NO (катализатор – Pt, Cr2O3)
2NH3 + 3CuO = N2 + 3Cu + 3H2O
- Соли аммония – твёрдые кристаллические вещества, растворимые в воде. При нагревании разлагаются:
NH4Cl = NH3↑ + HCl↑; (NH4)2Cr2O7 = N2↑ + Cr2O3 + 4H2O
- В промышленности аммиак получают по реакции:
N2 + 3H2 = 2NH3 (катализатор – Fe2O3, p = 35,5 МПа, t = 500 °C)
- Применение аммиака: хладагент, в производстве азотной кислоты, солей аммония. Соли аммония: удобрение, в пищевой промышленности, в производстве взрывчатых веществ, при выделке кожи.
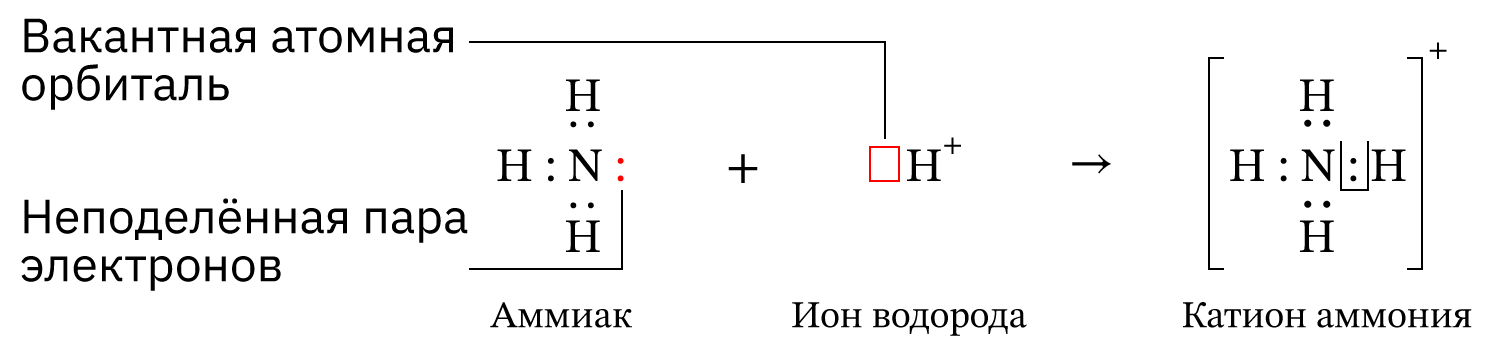
- Катион аммония образуется по донорно-акцепторному механизму: атом азота – донор, ион H⁺ – акцептор.